Le tétrafluorure de silicium (SiF4) possède un atome central de silicium (Si) avec 4 électrons de valence, formant des liaisons simples avec quatre atomes de fluor (F), chacun apportant 7 électrons de valence. La structure de Lewis montre quatre liaisons Si-F et aucune paire isolée sur le silicium, utilisant 8 électrons de liaison. SiF4 adopte une géométrie tétraédrique avec des angles de liaison d'environ 109.5°, caractéristique de l'hybridation sp³. La molécule est apolaire en raison de sa forme symétrique, malgré la forte électronégativité du fluor (3.98). Cette structure et la force des liaisons Si-F influencent considérablement les propriétés chimiques du SiF4, notamment sa réactivité et son rôle dans l'industrie des semi-conducteurs.

Discutons du point suivant dans cet article
- comment dessiner la structure de lewis pour SIF4
- paires isolées de structure de Lewis SIF4
- Forme de la structure Lewis SIF4
- Règle d'octet de structure de Lewis SIF4
- Hybridation SIF4
- Résonance de la structure de Lewis SIF4
- SIF4 polaire ou apolaire
- SIF4 lewis structure les charges formelles
- Forme de la structure Lewis SIF4
comment dessiner la structure de lewis pour SIF4
La forme d'une molécule dépend de la répulsion entre la paire de liaisons électroniques de valence ou la paire non liante. Dans la molécule SIF4, les quatre atomes de fluor sont entourés d'un atome central de silicium. L'atome de silicium a quatre électrons non appariés,
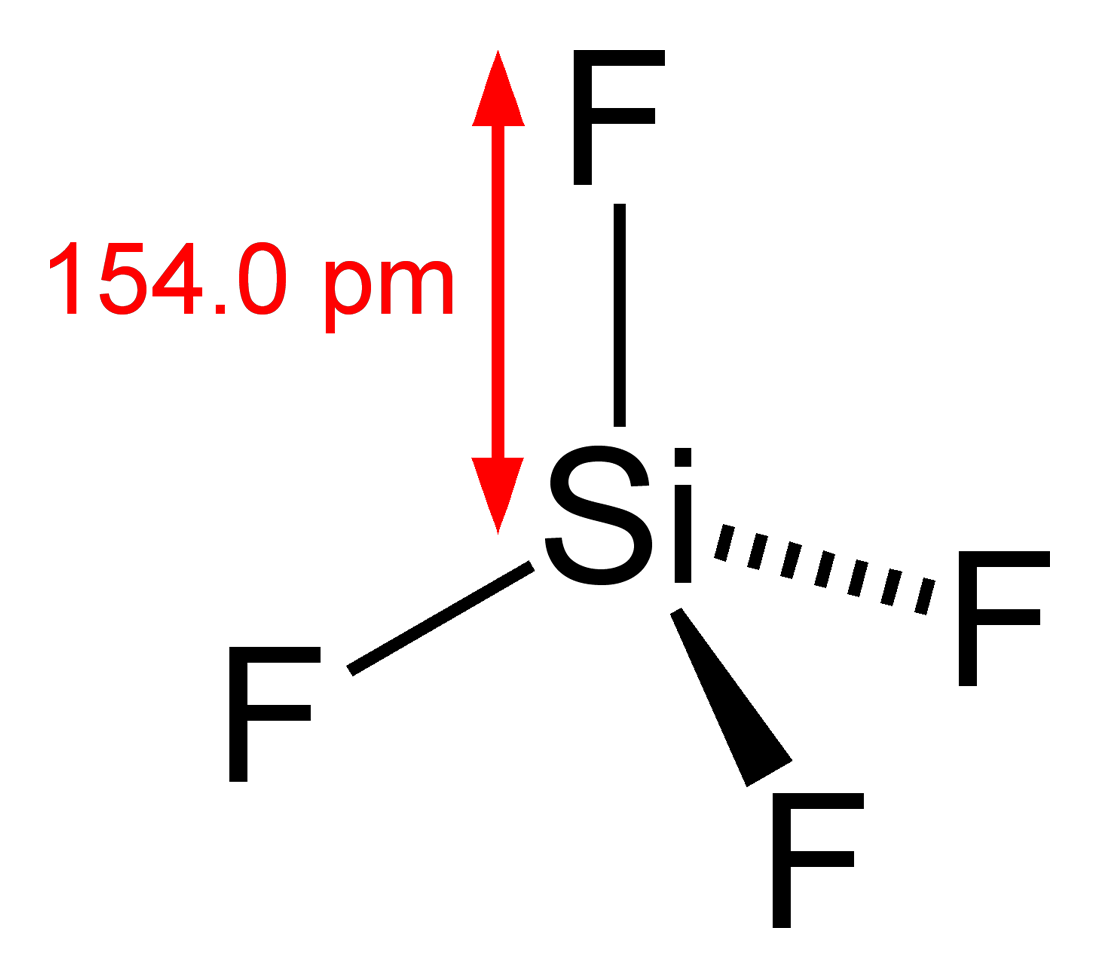
Selon la règle de l'octet, le silicium est associé à quatre autres atomes pour compléter son octet. Formez donc quatre liaisons Si-F. Selon la théorie VSEPR, la molécule SiF4 présente une géométrie tétraédrique, avec un angle de liaison de 109.5o et longueur de liaison de 154 pm.
paires isolées de structure de Lewis SIF4
Electron de valence d'un atome de silicium = 4×1=4
Electron de valence de quatre atomes de fluor = 7×4=28
Électrons de valence totaux = 32 il y a 16 paires d'électrons nécessaires pour une stabilité Structure de Lewis.
Dans la structure totale ci-dessus, nous avons 16 paires d'électrons avec quatre liaisons Si-F Il reste donc 12 électrons qui sont désignés par des paires isolées, pour chaque atome de fluor, il y a trois paires isolées donc un total de 12 paires d'électrons isolés sont présentes autour du silicium atome,
et le silicium a une paire nulle de l'électron car les 12 paires d'électrons sont présentes autour des quatre atomes de fluor.
Forme de la structure Lewis SIF4

Règle d'octet de structure de Lewis SIF4
Au dessus Structure de Lewis, le silicium et le fluor n'ont pas de charges et l'atome de silicium central complète son octet donc cette structure est une structure de Lewis stable. Pour une structure de Lewis stable, tous les atomes des molécules présentes doivent satisfaire à la règle de l'octet,
La règle de l'octet stipule que pour atteindre une configuration stable, la coquille de valence d'un atome contient huit électrons qui ressemblent à une configuration électronique du gaz noble le plus proche.
Dans la molécule SiF4, l’atome de fluor n’a besoin que d’un seul électron pour compléter son octet tandis que l’atome de silicium a besoin de quatre électrons pour compléter son octet et devenir stable. Les atomes de silicium et de fluor partagent un électron et complètent leur octet, l'hydrogène ayant deux électrons de valence et le silicium ayant huit électrons de valence de cette manière, ils complètent leur octet.
Hybridation SIF4
L'hybridation est un processus dans lequel les orbitales atomiques des deux atomes d'une molécule se rejoignent et se combinent pour former une orbitale hybride par chevauchement direct d'une liaison sigma, tandis que des parallèles côte à côte se chevauchent pour former une liaison pi.
Dans la molécule SiH4, la configuration électronique du silicium est,
Si : 1 s2 2s2 2p6 3s2 3p2
Si : [Ar] 3s2 3p2

D'après le diagramme ci-dessus, l'orbite s et l'orbite trois p se rejoignent et se combinent pour former 4 3p hybrides3 orbitales ces 4 orbitales hybrides forment quatre liaisons sigma avec quatre atomes d'hydrogène. Par conséquent, l'hybridation pour Si est sp3 dans SiH4.
Résonance de la structure de Lewis SIF4
La résonance est un phénomène chimique dans lequel les propriétés entières d'une molécule ne peuvent pas être expliquées par une seule structure. De nombreuses structures canoniques sont impliquées. Mais toutes les molécules ne peuvent pas présenter de résonance.
SiF4 structure de lewis ne présente pas de résonance car il n'y a pas de délocalisation des électrons et il y a présence de liaisons simples. Il n'y a donc pas de mouvement. Même s'il y a présence de paires d'électrons isolées, la délocalisation perturbe le facteur de stabilité. Il n'y a donc pas de résonance structures du SiFl4 lewis structure
SIF4 polaire ou apolaire
Les quatre atomes de fluor sont entourés d'un atome de silicium central dans la molécule SiF4, l'électronégativité de l'atome de silicium est de 1.90 et celle d'électronégativité de l'atome de fluor est de 3.98 la différence entre l'électronégativité du fluor et du silicium est de 2.08,
cette grande différence d'électronégativité entre le silicium et le fluor indique que les paires d'électrons sont fortement attirées vers l'atome de fluor, la liaison Si-F dans la molécule SiF4 est donc polaire. plus la différence d'électronégativité entre eux indique que la paire d'électrons est fortement attirée par l'atome de fluor, la liaison Si-F est donc hautement polaire.
SIF4 lewis structure les charges formelles
Dans la molécule de tétrafluorure de silicium, le nombre de charges réelles correspond aux charges formelles totales. Les charges formelles sont calculées par le SiF4 Structure en points de Lewis. Qui sont calculés par la formule suivante,
La charge formelle sur l'atome Si de la molécule SiF4 = électron de valence de la paire Silone de silicium -1/2 (paire de liaison d'électrons)
Selon la formule formelle de calcul de charge, l'atome de silicium a 4 électrons de valence, huit électrons de liaison et aucune paire isolée. d'où , Dans la molécule SiF4 Par conséquent, la charge formelle sur l'atome de silicium de la molécule SiF4 = (4- 0- (8/2)) = 0
Par conséquent, les charges formelles dans la molécule SiF4 sont nulles.
Forme de la structure Lewis SIF4
Structure tétraédrique de SiF4 illustrée ci-dessous :
Foire aux Questions
Quelle est la structure de Lewis de SiF4 ?
Réponse : Dans le Structure de Lewis de l'atome de silicium central de la molécule SiF4 est entouré de quatre atomes de fluor, il forme quatre liaisons Si-F, tous les atomes de fluor ont trois paires isolées sur chacun.
Quelles sont les similitudes et les différences entre les structures de Lewis de XeO3 et SIF4 ?
La Structure de Lewis xeo3 expliquée révèle que XeO3 et SiF4 ont des atomes centraux entourés de paires d'électrons et de paires de liaisons. Cependant, la principale différence réside dans le nombre de paires d’électrons et les angles de liaison. XeO3 possède 3 paires de liaisons et 2 paires isolées, ce qui donne une forme pyramidale trigonale avec des angles de liaison d'environ 109.5°. En revanche, SiF4 possède 4 paires de liaisons et aucun doublet libre, ce qui lui confère une forme tétraédrique avec des angles de liaison de 109.5°.
Comment prédire la forme de SiF4 ?
Réponse : La forme de SiF4 est prédite par la théorie VSEPR. L'atome de silicium central a quatre électrons de valence, il est donc attaché à quatre atomes de fluor et forme une géométrie tétraédrique.
Quelle est la signification de la structure de Lewis ?
Réponse : Il définit la nature de la liaison et la position des atomes de la molécule qui sont connectés dans la molécule. La représentation des molécules dans la structure de points d'électrons de Lewis ou simplement une structure de Lewis est en l'honneur du chimiste américain Gilbert Newton Lewis.
Lisez aussi:
- Structure Ncl2 Lewis
- Structure de Lewis Co2
- Structure Bao Lewis
- Structure Sncl2 Lewis
- Structure de Lewis H2so4
- Structure de Lewis Xecl2
- Structure Lewis Chf3
- Structure de Lewis Na2so4
- Structure de Lewis Bf3
- Structure H2o2 Lewis

Salut… Je m'appelle Darshana Fendarkar, j'ai terminé mon doctorat. de l'Université de Nagpur. Mon domaine de spécialisation est la chimie inorganique.
J'ai une expérience en tant que chimiste chez Earthcare Pvt. Ltd. J'ai également 2 ans d'expérience dans l'enseignement. Actuellement, je travaille avec Lambdageek en tant qu'expert en la matière.


Bonjour cher lecteur,
Nous sommes une petite équipe chez Techiescience, travaillant dur parmi les grands acteurs. Si vous aimez ce que vous voyez, partagez notre contenu sur les réseaux sociaux. Votre soutien fait une grande différence. Merci!