Comment trouver la réaction redox

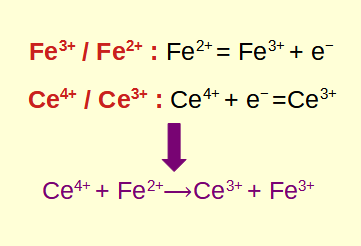

Les réactions redox, abréviation de réactions d'oxydo-réduction, sont des processus chimiques fondamentaux qui impliquent le transfert d'électrons entre réactifs. Comprendre comment identifier et calculer les réactions redox est crucial dans les domaines de la chimie et de la biologie. Dans cet article de blog, nous explorerons les bases des réactions redox, apprendrons à les identifier, approfondirons les calculs impliqués et explorerons leurs applications pratiques.
Comprendre les bases des réactions redox
Les réactions redox se produisent lorsqu'il y a un transfert d'électrons entre deux espèces. Une espèce perd des électrons (subit une oxydation) tandis que l’autre espèce en gagne (subit une réduction). Ce transfert d’électrons est dû à une différence d’électronégativité des atomes impliqués.
L’espèce oxydée est appelée agent réducteur car elle donne des électrons, tandis que l’espèce réduite est appelée agent oxydant car elle accepte des électrons. Il est important de noter que les réactions redox impliquent toujours à la fois une oxydation et une réduction, d’où leur nom.
Importance des réactions redox
Les réactions redox jouent un rôle crucial dans divers processus chimiques et biologiques. Ils sont impliqués dans la production d’énergie, la corrosion, la synthèse de produits chimiques et même le fonctionnement de notre propre corps. Par exemple, le processus de phosphorylation oxydative, qui se produit dans les mitochondries de nos cellules, repose sur des réactions redox pour produire de l'ATP, la monnaie énergétique universelle des cellules.
Exemples courants de réactions redox
Jetons un coup d'œil à quelques exemples courants de réactions redox :
Combustion : Lorsqu'une substance réagit avec l'oxygène pour produire de la chaleur et de la lumière, il s'agit d'une réaction redox. Par exemple, la combustion du bois ou la combustion de l’essence dans un moteur de voiture.
Rouille : Le processus de rouille implique l’oxydation du fer en présence d’oxygène et d’eau. Le fer perd des électrons, formant de l’oxyde de fer (III) (rouille).
Photosynthèse : Pendant la photosynthèse, les plantes convertissent le dioxyde de carbone et l’eau en glucose et en oxygène, avec l’aide de la lumière du soleil. Ce processus implique la réduction du dioxyde de carbone et l'oxydation de l'eau.
Identifier les réactions redox
Pour identifier une réaction redox, nous devons reconnaître les substances qui subissent une oxydation et une réduction. Voici quelques étapes clés pour nous aider à identifier rapidement les réactions redox :
Reconnaître l'oxydation et la réduction : recherchez les changements dans les états d'oxydation ou la perte/gain d'électrons. Si l'état d'oxydation d'un élément augmente, il est oxydé, tandis qu'une diminution de l'état d'oxydation indique une réduction.
Détermination du nombre d'oxydation : Le nombre d'oxydation est un concept utilisé pour déterminer la distribution des électrons dans un composé ou un ion. Cela nous aide à identifier le changement des états d’oxydation lors d’une réaction redox.
Identifier rapidement les réactions redox : Une méthode efficace pour identifier les réactions redox consiste à rechercher la présence de certains éléments ou composés connus pour subir des réactions redox. Par exemple, le peroxyde d’hydrogène (H2O2) est un agent oxydant courant, tandis que des substances comme le borohydrure de sodium (NaBH4) sont des agents réducteurs.
Calcul des réactions redox
Une fois que nous avons identifié une réaction redox, nous pouvons procéder à son calcul. Voici comment:
Trouver les demi-réactions : divisez la réaction redox en deux demi-réactions, l'une représentant l'oxydation et l'autre représentant la réduction. Cela aide à équilibrer l’équation plus tard.
Équilibrer la réaction redox : Équilibrez le nombre d'atomes de chaque côté de l'équation en ajustant les coefficients. Il est essentiel d’équilibrer à la fois la masse et la charge lorsqu’il s’agit de réactions redox.
Calcul de la réaction redox globale : combinez les demi-réactions équilibrées, en vous assurant que le nombre d'électrons gagnés lors de la réduction correspond au nombre d'électrons perdus lors de l'oxydation.
Concepts avancés dans les réactions redox
Pour approfondir notre compréhension des réactions redox, explorons quelques concepts avancés :
Détermination de la spontanéité des réactions redox : La spontanéité d'une réaction redox peut être déterminée en utilisant le concept de potentiel redox. Si le potentiel redox est positif, la réaction est spontanée, ce qui indique une probabilité plus élevée de se produire.
Trouver le coefficient des réactions redox : Les coefficients d'une réaction redox équilibrée représentent le nombre relatif de taupes de chaque espèce impliquée. Ces coefficients sont cruciaux pour les calculs stœchiométriques.
Comprendre le rôle des électrons dans les réactions redox : Les électrons sont les porteurs de charge dans les réactions redox. Ils voyagent de l’agent réducteur à l’agent oxydant, facilitant le transfert d’énergie.
Applications pratiques des réactions redox
Les réactions redox ont des applications pratiques dans divers domaines. Explorons quelques exemples :
Réactions redox dans la vie quotidienne : Le processus de respiration dans notre corps repose sur des réactions redox pour convertir le glucose en énergie. De plus, les piles que nous utilisons quotidiennement, comme les piles alcalines et les piles lithium-ion, fonctionnent sur la base de réactions redox.
Applications industrielles des réactions Redox : Les réactions Redox sont cruciales dans les processus industriels tels que l'extraction des métaux, la galvanoplastie et le traitement des eaux usées. Ils aident à éliminer les polluants nocifs et à les transformer en substances moins toxiques.
Réactions redox dans les systèmes biologiques : Dans le corps humain, les réactions redox sont impliquées dans divers processus biologiques, notamment le métabolisme, la détoxification et les réponses immunitaires. Cependant, des réactions redox excessives peuvent entraîner un stress oxydatif, susceptible d’endommager les cellules et de contribuer aux maladies.
Lisez aussi:
- Réaction de Knoevenagel
- Exemple de réaction dépendante de la lumière
- Réaction endothermique
- Réaction de substitution nucléophile
- Exemple de réaction de synthèse
- Réaction photochimique
- Exemple de réaction endergonique
- Exemple de réaction de premier ordre
- Exemple de réaction indépendante de la lumière
- Réaction de Kolbe

Bonjour,
Je suis Aditi Ray, une PME de chimie sur cette plateforme. J'ai obtenu un diplôme en chimie de l'Université de Calcutta et un diplôme post-diplôme de l'Université Techno India avec une spécialisation en chimie inorganique. Je suis très heureux de faire partie de la famille Lambdageeks et j'aimerais expliquer le sujet de manière simpliste.
Connectons-nous via LinkedIn-https://www.linkedin.com/in/aditi-ray-a7a946202

Bonjour cher lecteur,
Nous sommes une petite équipe chez Techiescience, travaillant dur parmi les grands acteurs. Si vous aimez ce que vous voyez, partagez notre contenu sur les réseaux sociaux. Votre soutien fait une grande différence. Merci!