Le niveau d'énergie
- Les niveaux de coquille d'électrons ou d'énergie seront les distances spécifiées du noyau d'un atome où des électrons pourraient être trouvés ou la probabilité la plus élevée de trouver. Les électrons sont des particules chargées négativement dans une molécule qui se déplacent autour du noyau positif, généralement situé au centre. Les niveaux d'énergie sont un peu comme les mesures des sauts d'électrons d'un pas.
- Dans la plupart des concepts fondamentaux d'un atome; se composent d'électrons en orbite autour d'un noyau.
- Cependant, les électrons ne sont pas capables de choisir une orbite selon leur souhait. Les électrons sont limités aux orbites avec seulement un certain niveau d'énergie. Les électrons ne peuvent sauter que d'un niveau d'énergie ou d'un pas à un autre. Les électrons ne peuvent pas orbiter avec des énergies autres que les niveaux d'énergie spécifiés.
Quel est le diagramme du niveau d'énergie?
Le niveau d'énergie signifie évaluer la quantité d'énergie que l'électron peut nécessiter et sera libérée pendant la transition, s'ils sautent d'une orbite à l'autre. La masse ou l'état zéro est l'état d'énergie minimum calculé pour H2 molécules.

Quels sont les quatre niveaux d'énergie?
Il existe quatre types d'orbitales: s, p, d et f.
- Sharp-s
- Principe-p
- Diffus
- Fondamental-f
Dans un atome, il existe certaines combinaisons de ces orbitales.
Le niveau d'énergie est une quantité d'espace ou de régions, où que électrons sera probablement présent. Ces distances, appelées orbitales, sont de formes différentes, désignées par une lettre (s, p, d, f).

Geek3, Nuages orbitaux atomiques SPDF M0, CC BY-SA 4.0
Comment déterminez-vous les niveaux d'énergie?

Bruce Blaus, Blausen 0342 ElectronEnergyNiveaux, CC BY 3.0
électrons de valence
«Les électrons qui sont au niveau d'énergie le plus élevé sont appelés électrons de valence.»
État fondamental
«L'état d'équilibre énergétique minimum du H2 l'atome est reconnu comme l'état fondamental. »
État excité
Lorsque l'électron (ou l'atome) a une énergie plus élevée que cette énergie la plus basse, on dit qu'il est dans un «état excité».
Si un électron passe d'un niveau supérieur à un niveau inférieur, un photon peut émettre ou de l'énergie est libérée.
Différence énergétique
L'énergie du photon émis est la différence entre les niveaux d'énergie du primaire (n i ) et final (n f ) Etat. L'énergie du photon émis est calculée à l'aide de la formule de Rydberg.
Le modèle de l'hydrogène de Bohr
En 1913, Niels Bohr a conceptualisé les niveaux d'énergie et la fréquence spectralen du H2 en considérant diverses hypothèses simples pour fixer l'hypothèse classique. La majorité de ces défauts ont été résolus par la modification d'Arnold Summerfield du modèle de Bohr. Pour ce modèle, le physicien Niels Bohr a reçu le prix Nobel de physique en 1922.
Dans le concept fondamental d'un atome (le modèle atomique de Bohr), les électrons ne tournent que sur certaines orbites autour du noyau. Les électrons qui descendent et montent entre les orbites autorisées, en plus de l'émission ou de l'absorption d'énergie, se produisent.
Bien que ce modèle de base ne soit pas bien accepté car la plupart de la structure des atomes est plus compliquée que l'hydrogène, bien que cela nécessite de nouveaux sujets, d'où l'introduction de la mécanique quantique, en mécanique quantique, chaque électron en orbite est expliqué par une expression mathématique connue sous le nom de une fonction d'onde.
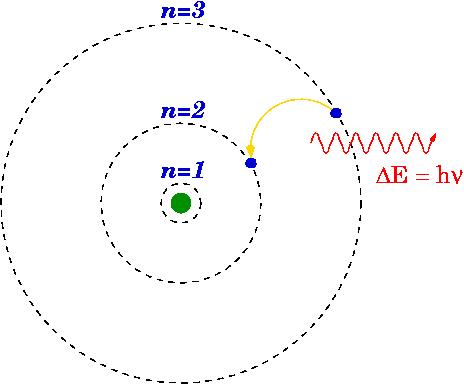
SauleW, Modèle d'atome de Bohr, CC BY-SA 3.0
Rayon de Bohr
«Le rayon de Bohr (a0) est un paramètre constant, est égal à la distance la plus prévisible pour l'atome d'hydrogène entre le noyau et l'électron à l'état fondamental (non relativiste et ayant un proton infiniment lourd)"
Il porte le nom de Niels Bohr en raison de sa part dans le modèle de Bohr d'un atome.

SE3-29X, Hydrogène GIF, CC BY-SA 4.0
Lignes spectrales
Chaque composant a un ensemble particulier de niveaux d'énergie. Ainsi, les fréquences dans lesquelles il absorbe et émet de la lumière se comportent comme une sorte de micro, identifiant le composé spécifique et particulier. Ces caractéristiques des atomes ont donné des recherches dans des sujets appelés spectroscopie, une science dédiée à l'identification des molécules et des atomes à partir du type de rayonnement qu'ils absorbent ou émettent.
Série Balmer
Le physicien atomique Balmer a noté analytiquement une relation dans les énergies lors de la libération des photons de l'atome. Les différentes énergies / longueurs d'onde discrètes des photons qui ont été découvertes par Balmer sont appelées la série Balmer.
On a su plus tard que les transitions d'énergie créent les lignes de Balmer à partir de l'atome d'hydrogène. Le modèle de Bohr de l'atome a réussi à définir la série Balmer parce que les orbites plus grandes avaient besoin d'électrons pour avoir beaucoup plus de puissance défavorable ou d'énergie négative pour s'équilibrer avec le moment cinétique. La formule Rydberg adopte une vision large de la série Balmer pour tous les ajustements de niveau énergétique.
Spectre d'émission
La Spectre d'émission d'hydrogène atomique a été divisé en de nombreuses séries spectrales et longueurs d'onde fournies par la formule standard de Rydberg. Ces raies spectrales détectées sont le résultat de la transition électronique de différents niveaux d'énergie dans un atome.
Un spectre d'émission désigne la variété de longueurs d'onde émises par un atome ou un composé chimique stimulé par le chauffage ou le courant électrique. Le spectre d'émission du gaz brûlant ou d'autres molécules peut également être utilisé pour illustrer sa composition.
Crédit image: Ranjithsiji, Spectre d'émission atomique d'hélium, CC BY-SA 4.0
Énergie potentielle
«Il s’agit de l’énergie d’une entité pour sa position par rapport à d’autres objets, à des contraintes, à une charge électrique stockée ou à d’autres facteurs en lui-même.
Énergie de liaison
«L'énergie de liaison est l'énergie minimale requise pour maintenir un noyau ensemble.»
Énergie d'ionisation
"La quantité d'énergie qu'un atome isolé dans l'état électronique fondamental devait absorber pour être déchargé en tant que e- "
L'énergie d'ionisation est décrite comme une étape de difficulté à éliminer un électron dans un atome ou un ion ou la capacité d'un atome ou d'un ion à rendre un électron. Le non de réduction d'électrons a généralement lieu dans l'état fondamental de l'espèce.
Les énergies d'ionisation sont mesurées en kJ / mol, ou la quantité d'énergie nécessaire pour que tous les atomes d'une mole soient respectivement desserrés à l'unité e-.
Comment fonctionne l'énergie d'ionisation?
L'énergie d'ionisation est l'énergie requise, dans laquelle un atome gazeux isolé de l'état électronique fondamental doit absorber pour libérer un électron. Plus il y a d'électrons perdus, plus cet ion sera + ve, et il sera plus difficile de séparer l'e- de l'atome.
Quel élément a l'énergie d'ionisation la plus élevée et la plus basse?
- L'élément He a l'énergie d'ionisation la plus élevée.
- Le francium a l'énergie d'ionisation minimale.
L'énergie d'ionisation d'un élément devient plus élevée de gauche à droite sur un tableau périodique et diminue de haut en bas généralement dans le tableau périodique.
Cdang et Adrignole, Tableau périodique des énergies d'ionisation, CC BY-SA 3.0
Pour en savoir plus sur le nuage d'électrons Cliquez ici
Lisez aussi:
- L'énergie potentielle est-elle de l'énergie stockée
- Types d'énergie cinétique
- Exemple d'énergie électrique en énergie rayonnante
- Exemple d'énergie mécanique à électrique
- De l'énergie gravitationnelle à l'énergie mécanique
- Formule énergie éolienne
- La masse affecte-t-elle l'énergie potentielle
- Énergie rayonnante en énergie chimique
- De l'énergie chimique à l'énergie sonore
- Exemple d'énergie cinétique à sonore

Je m'appelle Subrata, Ph.D. en ingénierie, plus particulièrement intéressé par les domaines liés aux sciences du nucléaire et de l'énergie. J'ai une expérience multi-domaines allant de l'ingénieur de service pour les lecteurs électroniques et les microcontrôleurs aux travaux de R&D spécialisés. J'ai travaillé sur divers projets, notamment la fission nucléaire, la fusion avec l'énergie solaire photovoltaïque, la conception de radiateurs et d'autres projets. J'ai un vif intérêt pour le domaine scientifique, l'énergie, l'électronique et l'instrumentation, ainsi que l'automatisation industrielle, principalement en raison du large éventail de problèmes stimulants hérités de ce domaine, et qui évolue chaque jour avec la demande industrielle. Notre objectif ici est d'illustrer ces sujets scientifiques complexes et non conventionnels d'une manière simple et compréhensible.

Bonjour cher lecteur,
Nous sommes une petite équipe chez Techiescience, travaillant dur parmi les grands acteurs. Si vous aimez ce que vous voyez, partagez notre contenu sur les réseaux sociaux. Votre soutien fait une grande différence. Merci!